Тецентрик цена, отклики, инструкция по применению, рекомендации читайте в описании препарата.
Противоопухолевое средство; гуманизированное моноклональное антитело против лиганда-1 запрограммированной смерти (анти-PD-L1).
Это препарат для химиотерапии или иммунотерапии?
Атезолизумаб (торговая марка: Tecentriq) – это тип иммунотерапевтического препарата, который называется «ингибитор иммунных контрольных точек». Он помогает стимулировать иммунную систему организма для борьбы с некоторыми видами рака, включая рак легких, печени и кожи.
Состав, механизм действия и применение
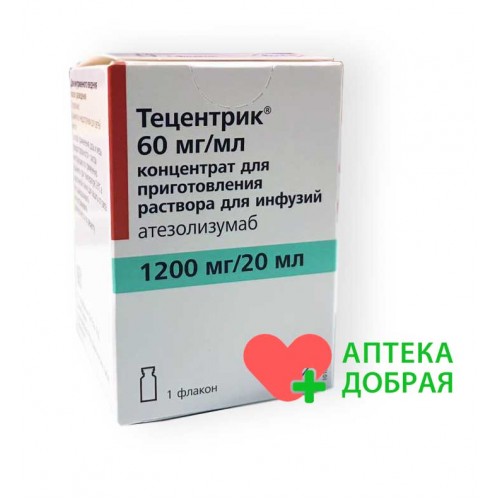
Тецентрик 1200 мг (Tecentriq атезолизумаб) является
противоопухолевым препаратом, применяемым в лечении некоторых видов рака.
Атезолизумаб является моноклональным антителом, которое препятствует
взаимодействию белка PD-L1 с рецепторами PD-1 и B7.1, которые находятся на
поверхности иммунных клеток и опухолевых клеток. Это приводит к активации
иммунной системы и усилению ее борьбы против раковых клеток.
Тецентрик применяется в лечении нескольких видов рака,
включая метастатический не мелкоклеточный рак легкого, мочевого пузыря, тройной
отрицательный метастатический рак молочной железы и другие.
Действующие вещества
Основным действующим веществом препарата является
атезолизумаб, моноклональное антитело, которое блокирует PD-L1.
Способ применения
Тецентрик применяется в виде инфузии в вену. Обычно препарат
вводят каждые 2-3 недели, в зависимости от рекомендаций врача.
Риски применения
Как и любой медикамент, Тецентрик может вызывать
нежелательные эффекты. Некоторые из них могут быть серьезными, включая
аллергические реакции, инфекции, воспаления легких, повышенный риск
кровотечений и другие.
Противопоказания
Тецентрик не рекомендуется применять при наличии
аллергической реакции на атезолизумаб или любой из компонентов препарата. Также
препарат может быть нежелательным для пациентов с определенными заболеваниями,
такими как активная инфекция, иммунодефицитные состояния и другие.
Побочные эффекты препарата
Некоторые из наиболее распространенных побочных эффектов
Тецентрик включают тошноту, рвоту, диарею, усталость, потерю волос, снижение
аппетита и другие. Однако, некоторые побочные эффекты могут быть серьезными,
включая аллергические реакции, пневмонит, гепатит и другие.
Исследования эфективности
Клинические исследования показали, что Тецентрик эффективен
в лечении различных видов рака. В частности, препарат может увеличить
выживаемость пациентов с метастатическим не мелкоклеточным раком легкого,
мочевого пузыря, тройным отрицательным метастатическим раком молочной железы и
другими видами рака.
Купить можно в интернет аптеке aptekadobraya.com
Покупка Тецентрика возможна только по рецепту врача, и
препарат можно приобрести только в аптеке. Однако, некоторые аптеки могут
предложить заказать препарат через интернет и доставить его по почте. Важно
помнить, что приобретать медикаменты через интернет следует только на
проверенных сайтах и у надежных поставщиков, чтобы избежать подделок и
мошенничества.